اسهال ویروسی گاو و بیماری مخاطی
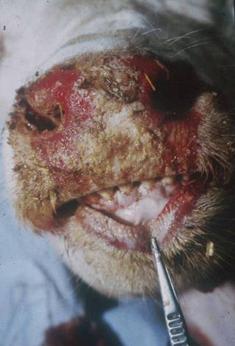
اسهال ویروسی گاوی (BVD ) و بیماری مخاطی (MD) دو مورد از چندین نشانگان بیماری در گاو هستند که توسط ویروس اسهال ویروسی گاوی (BVDV) ایجاد می شوند. تأثیر اقتصادی اولیه BVDV عمدتاً در سطح رویان گاوی یا جنین است که منجر به مرگ رویان/جنین، کژریخت سازی، عفونت مداوم یا عفونت پنهان و عملکرد ضعیف پس از تولد می شود. یکی از پیامدهای دیررس برخی از عفونت های جنینی، تولد گوساله هایی با عفونت های پایا است که متعاقباً منجر به ایجاد MD، شکل شدید BVD با سبب شناسی غیرمعمول می شود. عفونتهای مقدماتی پس از زایمان در گاو معمولاً منجر به شکل خفیف BVD میشود که با بیاشتهایی، تب و لکوپنی مشخص میشود. با این حال، مواردی از بیماری شدید و گاهی کشنده ناشی از BVDV در گاو که تب، اسهال، بیماری تنفسی و/یا سندرم هموراژیک عمومی را نشان میدهد گزارش شده است. چندین بررسی دقیق در مورد جنبه های مختلف بیماری منتشر شده است.6، 17، 23، 113، 138، 178، 183، 210، 220
اسهال ویروسی گاوی اولین بار در سال 1946 در ایالات متحده توسط اولافسون و همکارانش توصیف شد. 163 این بیماری با سقط جنین، تب، بی اشتهایی، اسهال و زخم در دستگاه گوارش مشخص می شود. میزان ابتلا بالا بود و مرگ و میر در همه گیری ها 4 تا 8 درصد بود. نشانگانی سازگار با بیماری مخاطی، که در ابتدا به عنوان "بیماری X" نامیده می شد، برای اولین بار در کانادا، همچنین در سال 1946، توسط Childs ثبت شد.58 Ramsey و همکاران در سال 1953 در آیووا، ایالات متحده، بر اساس مشاهدات خود از ماهیت بیماری و ضایعات ، اصطلاح "بیماری مخاطی" را وضع نمودند.186
سبب شناسی بیماری:
ویروس اسهال ویروسی گاوی عضوی از جنس Pestivirus از خانواده Flaviviridae است(به مقدمه کلی: Flaviviridae مراجعه کنید). 140 در حال حاضر، چهار گونه از آفت ویروس ها توسط کمیته بین المللی طبقه بندی ویروس ها به رسمیت شناخته شده است. BVDV-1، BVDV-2، ویروس بیماری مرزی و ویروس کلاسیک تب خوکی/وبای خوکی. (مراجعه کنید به بیماری مرزی و تب خوکی کلاسیک). تعداد گونه های موجود در جنس Pestivirus مطمئناً افزایش می یابد زیرا آفت ویروس های "غیر معمول" خوکی و سم داران وحشی به طور رسمی طبقه بندی می شوند. یک ویروس جدید BVDV به نام Hobi یا BVDV-3 ممکن است گونه سومی را در گروه آفت ویروس گاوی ایجاد کند. 208، 210 ژنوتیپ های مختلف (زیرگروه) در این گونه گزارش شده است، اما ارتباط بیولوژیکی آنها هنوز مشخص نشده است.
ویشه ها (ویریون های) اسهال ویروسی گاوی ذرات کروی با قطر تقریبی 50 نانومتر، با پوشش محکم چسبنده حاوی گلیکولیپیدها هستند. 140 شناسایی ویشه ها توسط میکروسکوپ الکترونی رنگ منفی دشوار است، اما ذرات کروی تقریباً با هسته 20 تا 25 نانومتردر سلول های آلوده که در آن ویروس به طور کامل در سیتوپلاسم تکثیر می شود قابل تشخیص هستند. 101 از آنجایی که ویروس دارای پوششی غنی از چربی است، نسبت به اکثر ضدعفونی کننده های رایج حساس است.140
زادان (ژنوم) BVDV از یک رشته RNA با قطبیت مثبت تشکیل شده است و شامل یک چهار چوب خوانشی باز بزرگ (ORF) است که یک پلی پروتئینی متشکل از تقریباً 3900 اسید آمینه را رمزگذاری می کند قبل از این چارچوب خوانشی باز یک ناحیه ترجمهنشده کوتاه (UTR) وجود دارد که سنتز پروتئین را آغاز میکند. 176رسیدگی پروتئین متعاقب برش همزمان و پس از ترجمه پلیپروتئین توسط پروتئازهای ویروسی و سلول میزبان محقق می شود. به جز اولین پروتئین رمزگذاری شده توسط زادان BVDV (Npro - یک پروتئاز ویروسی)، پروتئین های ساختاری توسط یک سوم اول زادان (انتهای "5) کدگذاری می شوند، در حالی که پروتئین های غیر ساختاری توسط دو سوم آخرین زادان رمزگذاری می شوند.220
پروتئینهای ساختاری شامل پروتئین پوشینه داخلی (کپسید = C) و پروتئینهای لفافه سطحی ویشه هستند. Erns (یا E0) تنها به سستی با ویشه مرتبط است و دارای فعالیت RNase ذاتی است. این فعالیت RNase برای مهار پاسخ های اینترفرون در سلول های آلوده گزارش شده است. 119، 144 E1 یک گلیکوپروتئین عرضی غشایی است که با گلیکوپروتئین E2 یک دو پاره (دایمر) را روی سطح ویشه تشکیل می دهد (شکل 1). قطعه دومی، گلیکوپروتئین ویشه اصلی، هدف اصلی پادتن های خنثی کننده ویروس بوده و پروتئین اتصالی گیرنده ویروس است که محدوده میزبانی را تعیین می کند.
پروتئینهای غیرساختاری (NS) (P7، NS2-3، NS2، N3، NS4A، NS4B، NS5A و NS5B) درویشه های بالغ ادغام نگشته و در روند تکثیر ویروس/تولید RNA و ریخت زایی ویروسی عمل میکنند. NS5B یک RNA پلیمراز وابسته به RNA است، اما همانندسازی زادان RNA به پروتئینهای NS3-NS5B نیاز دارد که هماهنگ عمل می کنند. بعنوان یک قاعده کلی در مورد پروتئین های ویروسی، عملکردهای متعددی در یک پروتئین ویروسی وجود دارد. چنان که، NS3 دارای یک منطقه پروتئاز سرین با فعالیت هلیکاز و فعالیت NTPase است. علاوه بر فعالیت های آنزیمی، NS3 به تنهایی یا در هماهنگی با پروتئین NS2-3 شکافته نشده، برای مورفوژنز ویروسی ضروری است. Npro به عنوان اولین پروتئین ترجمه شده یک خودپروتئاز است که خود را از پروتئین بعدی در ORF آزاد می کند، پروتئین کپسید C . Npro برای تکثیر ویروس در شرایط آزمایشگاهی ضروری نیست، اما این توانایی را دارد که با القای پاسخ IFN-1 مخالفت کند، هرچند ضعیف. در ارتباط با Erns، Npro ممکن است در سرکوب پاسخ های ضد ویروسی در حیوانات آلوده نقش داشته باشد.220
دو زیست گونه از BVDV در آزمایشگاه قابل شناسایی هستند: جدایه های غیر سیتوپاتیک که به وضوح بر یکپارچگی یاخته های کشت شده تأثیر نمی گذارند و جدایه های سیتوپاتیک که اثرات سیتوپاتیک و کشنده بر یاخته های آلوده را القا می کنند. زادمون ها (ژنو تیپ ها) اعضای متنوع هر یک از گونه های BVDV بوده80, 194 و جدایه های غیر سیتوپاتیک و سیتوپاتیک در هر زادمونی وجود دارند. زادمونها معمولاً بر اساس توالی بازی ناحیه نسبتاً محفوظ و ترجمهنشده 5’ زادان آنها طبقهبندی میشوند194، اما از زادانهایی مانند NS3 نیز استفاده شده است. الگوهای زادمون سازی عموماً پذیرفته نشدهاند و ارزش آنها ممکن است فقط در زمینه همه گیر شناسی باشد زیرا هیچ مطالعهای ارتباط زیستی منحصربهفردی را با یک زادمون مشخص نشان نداده است. عفونتهای اولیه شدید پس از زایمان ناشی از BVDV-2 تنها در سالهای اخیر شناسایی شدهاند و این منجر به این گمانهزنی شده است که جدایههای BVDV-2 خطرناکتر از جدایههای BVDV-1 هستند. 33, 87, 162اگر چه BVDV-2 در آمریکای شمالی شناسایی شده است، شواهد نشان می دهد که هر دو گونه BVDV در گاوها در سراسر جهان گردش می کنند. 50، 213، 248 ویروس BVDV-2 همراه با زیرگروه های متعدد BVDV-1 در جنوب آفریقا شناسایی شده اند. میزان شیوع این دو گونه مشابه آنچه که در ایالات متحده گزارش شده می باشد - 80 درصد BVDV-1 و 20 درصد BVDV-2 است.236
اگرچه همه آفتویروسها از نظر پادگنی مرتبط هستند، دادههای خنثیسازی ویروسی گزارششده توسط چندین محقق نشان میدهد که BVDV متعلق به زادمونهای مختلف (مبتنی بر UTR) ممکن است دارای اپی توپهای منحصربهفرد پادگنی (خنثیسازی) باشند. 30, 59, 71, 166 به منظور عمومیت یافتن این واقعیت لازم است که ویژگی های خاص ناحیه UTR به نحوی ملازم با توالی هایی در ناحیه ترجمه شده ویروس باشند. این واقعیت که ویروسهای هیبریدی زنده را میتوان ساخت نشان میدهد که زادمونهای تعریفشده با UTR ممکن است با انواع پادگنی همبستگی نداشته باشند.
تجزیه و تحلیلپادگنی جدایه های BVDV بر اساس خنثی سازی ویروس با پاد سرم های پلی کلونال و مونوکلونال تأیید کرده است که تغییرات قابل توجهی در برخی از اپی توپ های دخیل در خنثی سازی ویروس وجود دارد. 30, 59, 82, 167, 171, 238, 250 به نظر می رسد که بخش عمده این اپی توپها در گلیکوپروتئین اصلی (E2) موجود در سطح ویروس باشد. نواحی زادانی (ژنومی) رمز کننده دو آمینو اسید قرار گرفته در این پروتئین ممکن است متغیرترین ناحیه زادانی BVDV باشند. زادان BVDV، همانند بیشتر ویروسهای RNA دار، بسیار متغیر بوده و چنین ویروسهایی از نظر زیستشناسان مولکولی بعنوان «شبه گونه» در نظر گرفته می شوند.77 این تنوع به پیچیدگی طبقهبندی جدایههای BVDV منجر می شود. 71، 85، 171، 238 بنابراین، شبه گونه های BVDV را بایستی به عنوان زاد مونهایی(ژنوتیپ هایی) متشکل از خانواده هایی از گونه های مرتبط پادگنی در نظر گرفته و گونه های موجود در هر زادمونی ممکن است بیشتر به یکدیگر مرتبط باشند تا گونه های موجود در زادمونی دیگر. این احتمال وجود دارد که پاسخ خنثی گری پادتن های میزبانی به طور قابل توجهی به تکامل اپی توپ های گلیکوپروتئین سطحی ویروس کمک کند. تعجب آور نیست که ویروسی با چنین ژنوم قالب پذیری ، گونه هایی با تفاوتهای گسترده ای به لحاظ پادگنی ، حدت و شاید گرایش بافتی یا یاخته ای ایجاد کند. شناسایی اثر انگشتهای پادگنی بی مانند گلیکوپروتئین E2 در تک جدایه های(ایزوله های) BVDV برای درک روند بیماریزایی MD مهم است (به پاتوژنز مراجعه کنید).
غالب جدایه های میدانی BVDV غیر سیتوپاتیک بوده و دارای ژن NS2-3 "دست نخورده" هستند؛ 77،169 جرم مولکولی محصول زادان (ژن) 125 کیلو دالتون است. جدایه های سیتوپاتیک BVDV اغلب از حیوانات مبتلا به MD جدا می شوند و علاوه بر محصول ژن NS2-3، حداقل دو محصول شکافته اضافی، یعنی یک پروتئین 54 کیلو دالتون (NS2) و یک پروتئین 80 کیلو دالتون (NS3) تولید می کنند. محصول دومی یک نشانگر مولکولی برای جدایه های BVDV سیتوپاتیک در نظر گرفته میشود و اثر سیتوپاتیک ممکن است به دلیل تولید NS3 در یاخته های آلوده باشد که منجر به افزایش معنی داری درروند تولید RNA میشود که آغاز گر روند پاسخی مرگ برنامه ریزی شده یاخته های (آپاپتوزیس) است. 77، 78، 220 به نظر می رسد که تولید محصولات شکافته NS2-3 نتیجه رخداد های نوترکیبی درطی روند تکثیر ویروسی باشد. این رخداد ها شامل قرارگرفتن توالیهای RNA یاخته ای دردرون ژن NS2-3 یا ژن های ویروسی تکراری است که در این ناحیه یا در نواحی همسایه زادان(ژنوم) وارد میشوند14, 91, 92, 149, 184, 196, 218, 219.به هر حال رخداد نوترکیبی که منجر به لاگذاری ژنتیکی در جدایه های غیر سیتوپاتیک میشود، همیشه باعث تبدیل زیست گونه ای نمیشود. 197در برخی موارد، ویروسهای سیتوپاتیک جهش یافته ناشی از رخداد حذف یا جهش نقطه ای بوده تا بروزرخداد نوترکیبی. برخی از این جدایه ها معیوب بوده و وابسته به روند همانند سازی در حضور یک ویروس غیر سیتوپتیک "کمک کننده" هستند.
برای دریافت مقاله کامل با روئوس مطالب شامل : همه گیر شناسی، روند بیماری زای، نشانه های بالینی ، آسیب شناسی، ایمنی شناسی، تشخیص، تشخیص تفریقی، کنترل با ما تماس بگیرید.












